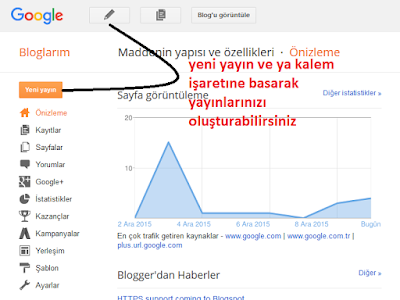
Yrd.Doç.Dr. Arif Çömek tarafından verilen Öğretim Teknolojileri ve Materyal Tasarımı dersi proje uygulaması olarak hazırlanmıştır.
24 Aralık 2015 Perşembe
9 Aralık 2015 Çarşamba
Google eğitim uygulamaları:Görsellerle arama
Google Görseller, Web üzerindeki en geniş kapsamlı görsel arama.
Görsellerle aramanın üç yolu vardır:
1) URL ile arama
Arama sonucu
2) Görsel yükleyerek arama:
Arama sonucu
3) Resmi sürükleyerek arama:
Arama kutusuna görseli sürükleyip bırakarak arama
Arama kutusuna görseli sürükleyip bırakarak arama
Google eğitim uygulamaları: Hangouts
Hangouts
Hangouts nedir?
Hangouts Google tarafından üretilmiş olan mesajlaşma uygulamasıdır. Google daha önceden kullanmakta olduğu Google Talk servisini kapattıktan sonra aktif olarak bu uygulamayı kullanmaya başlamış ve mesajlaşma konusunda bu uygulamayı servislerine dahil etmiştir.
Hangouts ne işe yarar?
Hangouts whatsapp benzeri ücretsiz olarak mesajlaşmaya yarayan bir uygulamadır. Uygulamayı whatsapp’dan ayıran temel özelliklerin başında Google’ın Gmail ve Google+’a dahil ettiği bu özellik sayesinden bilgisayar üzerinden çok kolay bir şekilde telefonlara anlık mesajlar gönderebilme olanağı sağlanmıştır. Görüntülü ve sesli görüşme özellikleri de bulunduran Hangouts android işletim sistemi kullanan cihazlar arasında ve hangouts kullanan google servisleriyle bilgisayarlar ile telefonun görüntülü konuşmasına olanak sağlamaktadır. Bu uygulama ile bilgisayar ile telefonu arayabilirsiniz. Uygulama ile birlikte wifi veya hücresel internet bağlantısı bulunan tüm cihazlar arasında görüşme sağlayabilirsiniz.
Hangouts eğitimde nasıl kullanılır?
Video konferans, canlı yayın ve youtube video yükleme özelliği sayesinde dersler internet ortamında canlı olarak izlenebilir.
Hangouts grubu kurularak(whatsapp grubuna benzer) derslerle ilgili fotoğraflar, döküman linkleri paylaşılabilir.
Hangouts video konferans özelliği:
Kaynakça:
Google eğitim uygulamaları:Google Goggless
Google Goggles
Google Goggles nedir? Google Goggles hizmeti uzun süredir var olan ama sürekli geliştirilen bir Google Labs uygulaması.Google çıkış noktası olan ve en çok güvendiği arama sistemini sunduğu tüm hizmetlerin içine entegre etmeyi çok seviyor. Goggles'ta aslında akıllı bir görsel arama, tarama ve tanıma sistemi. Cep telefonunuz aslında Google'ın bir gözü olarak çalışıyor ve size gösterdiğiniz şeyin ne olduğunu tanımaya ve anlamlandırmaya çalışıyor. Sonuçlar İngilizce olarak başarılı olsa da Türkçe için özellikle metin tanıma da fazlaca yol katetmesi gerekiyor.
Google Goggles ne işe yarar?
1. Ürünler üzerinde yer alan barkod ve qrcode taraması yapabilirsiniz. Eğer ürün internet üzerinden satılıyorsa linklerini ya da görsel olarak ürünün kendisini aratabilirsiniz.
2. Firma logolarını tarayabilir ve ilgili firmanın web sitesine ya da markanın diğer logo görsellerine ulaşabilirsiniz.3. Ünlü yerleşim yerlerinde ki tarihi binalar, ünlü ressamların yaptığı portreler ve benzeri Google resim servisinin tanımlayabileceği her nesneyi taratabilirsiniz.
4. Okuduğunuz kitaptaki bir paragrafı, etikette yazan bir cümleyi taratıp 40 dilde çevirisini gerçekleştirebilirsiniz. (Türkçede henüz doğruluk değerleri çok düşük.)
5. Kartvizit üzerindeki veya Qrcode içindeki bilgileri rehberinize ekleyebilirsiniz. Kartvizit üzerinde yer alan yazı fontunun Google tarafından tanınması yeterli.
6. OCR yazılımı olarak kullanabilirsiniz.
7. 2D resimler: DVD, cd, yağlı boya tabloların bilgilerini elde edebilirsiniz.
8. Sudoku bulmacasını çözmenizde size yardımcı olmakta.
Google Goggles eğitimde nasıl yararlanılır?
Özellikle gezi gibi ders dışı faaliyetlerde işimize yarayacak bir uygulama. Günümüzde pek çok öğrencinin akıllı telefonu bulunmakta. Herhangi bir müze gezisinde eserleri tanımlayabilecek uygulama tek gereken eserin resmini çekmek. Böylelikle gittikleri geziler öğrenciler için daha akılda kalıcı olacaktır.
Google goggles kullanmı:
Google eğitim uygulamaları:Google Dökümanlar, E-Tablolar ve Slaytlar nedir, ne işe yarar?
Google Dökümanlar
Google Dokümanlar nedir? Metin dokümanı oluşturup biçimlendirmenize ve diğer kullanıcılarla gerçek zamanlı olarak ortak çalışma yapmanıza olanak tanıyan çevrimiçi bir kelime işlemcidir.
Google Dokümanlar ne işe yarar?
- Bir Word dokümanı yükleyip Google dokümanına dönüştürebilirsiniz
- Boşlukları, aralıkları, yazı tiplerini ve renkleri ayarlamak gibi eğlenceli şeyler yaparak dokümanlarınıza stil ve biçimlendirme kazandırabilirsiniz
- Başkalarına düzenleme, yorum yapma veya görüntüleme erişimi vererek, onları sizinle birlikte bir dokümanda ortak çalışma yapmaya davet edebilirsiniz
- Gerçek zamanlı olarak ortak çalışma yapabilir ve diğer ortak çalışanlarla doğrudan dokümanının içinden sohbet edebilirsiniz
- Dokümanınızın düzeltme geçmişini görüntüleyebilir ve herhangi bir sürüme geri dönebilirsiniz
- Bir Google dokümanını masaüstünüze Word, OpenOffice, RTF, PDF, HTML veya zip dosyası halinde indirebilirsiniz
- Bir dokümanı başka bir dile çevirebilirsiniz
- Dokümanlarınızı diğer kullanıcılara e-posta eki olarak gönderebilirsiniz
Google E-Tablolar
Google E-Tablolar nedir?Google E-Tablolar, e-tablo oluşturup biçimlendirmenize ve eş zamanlı olarak diğer kullanıcılarla çalışmanıza olanak tanıyan çevrimiçi bir e-tablo uygulamasıdır.
Google E-Tablolar ne işe yarar?
- Excel, .csv, .txt ve .ods biçimindeki verileri içe aktarıp Google e-tablosuna dönüştürebilirsiniz
- Excel, .csv, .txt ve .ods biçimindeki veriler ile PDF ve HTML dosyalarını dışa aktarabilirsiniz
- Verileriniz üzerinde hesaplamalar yapmak için formül düzenlemeyi kullanabilir ve istediğiniz şekilde görünmesini sağlamak için biçimlendirmeden yararlanabilirsiniz
- E-tablonuzu düzenleyen diğer kullanıcılarla gerçek zamanlı olarak sohbet edebilirsiniz
- Verilerinizle grafikler oluşturabilirsiniz
- Blogunuza veya web sitenize e-tablonuzun tamamını veya dilediğiniz sayfalarını yerleştirebilirsiniz
Google Slaytlar
Google Slaytlar nedir?Google Slaytlar, çalışmanızı görsel bir şekilde sergilemenize olanak tanıyan çevrimiçi bir sunu uygulamasıdır.
Google Slaytlar ne işe yarar?
- Sunu oluşturabilir ve oluşturduğunuz sunuları düzenleyebilirsiniz
- Arkadaşlarınız veya iş arkadaşlarınızla bir sunuyu düzenleyebilir ve kolayca diğer kullanıcılarla paylaşabilirsiniz
- .pptx ve .pps dosyalarını içe aktarabilir ve Google sunularına dönüştürebilirsiniz
- Sunularınızı .pdf, .ppt, .svg, .jpg veya .txt dosyası olarak indirebilirsiniz
- Sunularınıza resimler ve videolar ekleyebilirsiniz
- Sunularınızı bir web sitesinde yayınlayabilir veya bir web sitesine yerleştirebilirsiniz
Google Dökümanlar, E-Tablolar ve Slaytlar eğimde nasıl yararlanılır?
Google, hayatımızın bir çok alanında olduğu gibi eğitimde de oldukça önemli kolaylıklar sağlıyor. Google Uygulamalar, Dokümanlar, Slaytlar, E-Tablolar, Formlar gibi öğretmenlerin sınıflarında öğrencileri ile birlikte kullanabilecekleri pek çok uygulamadan oluşuyor. Bu modül, katılımcıların hem profesyonel hayatlarında hem de öğrenme ve öğretme etkinliklerinde kullanabilecekleri Google uygulamalarından en iyi şekilde faydalanmalarını sağlayacak bilgiler ve stratejiler içeriyor.
Google e-tablo kullanımı:
Google slayt kullanımı:
Google döküman kullanımı:
Kaynakça:
Google eğitim uygulamaları:google drive nedir, ne işe yarar?
Google drive
Google drive nedir? 15gb'a kadar ücretsiz online depolama servisi.
Google drive ne işe yarar? Döküman, e-tablo, slayt, form, çizim ve harita oluşturmamızı aynı zamanda bu belgeleri çevrelerimiz ile ve ya internet kullanıcılarıyla paylaşmayı; halihazırda var olan dosyaları da drive yükleyip paylaşmamızı sağlar.
Google drive eğitimde nasıl yararlanılır? Google Drive okul ortamlarında özellikle öğretmen-öğrenci dosya paylaşımlarında kullanılabilir.
Google drive kullanımı:
Google eğitim uygulamaları:Takvim nedir, ne işe yarar?
Google Takvim
Google Takvim nedir? Google Takvim, 13 Nisan 2006 tarihinde Google tarafından hizmete sokulan, kullanıcılar için takvim ve ajanda hizmeti sunan servistir. Bu hizmetten internet kullanıcılarının yararlanması için Google'a üye olmaları gerekmektedir.
Google Takvim ne işe yarar? Etkinlik oluşturabiliriz ve bu etkinlikler bize hatırlatılır..Her yerden programlarımıza
ulaşabiliriz. Çevrimdışı etkinliklerimizi görüntüleyebilir ve yanıtlayabiliriz.
Google Takvim eğitimde nasıl yararlanılır?Grup takvimleri oluşturma ve paylaşma :Grup takvimleri sayesinde çalışma grubunuza özel bir etkinlik takvimi oluşturabilir, böylece kişisel takvimlerinizden ayrı bir takvim üzerinde tüm ajandanızı görebilirsiniz. Servisin sağladığı filtreleme seçenekleri onlarca ayrı takvimi bir arada yürütmeye oldukça yatkın.
Google eğitim uygulamaları:Gmail (hesap aktarma, sekmeler) nedir, ne işe yarar?
Gmail
Gmail nedir? Gmail google'ın ücretsiz elektronik posta hizmetidir.
Gmail ne işe yarar? Gmail e-posta hesabı olan kişilerle haberleşme, dosya(resim, video, microsoft office belgeleri) gönderme ve ya google'ın diğer hizmetlerinden(youtube, google drive,blogger.com,google play, haritalar, lucidchart) yararlanmayı sağlar.
Gmailden eğitimde nasıl yararlanılır? Gmail eğitimde çok önemli bir yere sahiptir. örneğin artık youtube da bir sürü eğitim videosu bulunmaktadır. öğretim materyallerinin oluşturulması ve paylaşımında çok önemli bir rolü bulunmaktadır.
Google eğitim uygulamaları:Blog: blogger.com nedir, ne işe yarar?
Blog: blogger.com
Blog ne işe yarar? Bir çok yayını(yemek tarifleri, dersler için konu anlatımları, oyunlar, haber, günlük, alışveriş, vb.) internet kullanıcıları ile paylaşmaya yarar.
Blogtan eğitimde nasıl yararlanılır? Bloglar yardımıyla dersin içeriği, etkinlikler, konu anlatımları, testler, sunumlar, kavram haritaları gibi bir çok ders materyali öğrenciler ile ücretsiz olarak paylaşılabilir. Böylelikle internet çağında yaşayan çocuklar için dikkat çekici materyaller hazırlanmış olur.
Blog nasıl oluşturulur?
Öncelikle bir blog oluşturmak için bir gmail hesabına sahip olmanız gerekiyor.
https://www.blogger.com/ sitesine girin ve google hesabınızla oturum açın.
https://www.blogger.com/ sitesine girin ve google hesabınızla oturum açın.
Güncel mobil uygulamalar(GradeCam, Evernote, Dropbox,ITunes U)"Nedir? Ne işe yarar? Eğitimde nasıl yararlanılır?"
Gradecam:
Gradecam, bir optik okuyucu uygulamasıdır. Kameraya cevap belgeleri tutulur ve anında sonuçlar alınır. Öğrencilerin sorulara verdikleri cevapları, hangi sorulara doğru, hangi sorulara yanlış cevap verdikleri grafik şeklinde sunulur.
GradeCam optik örneği
GradeCam eğitimde, anket, sınav gibi optik forma dönüştürelebilinen belgelerin hızlı ve doğru bir biçimde okunmasını sağlar.
Evernote
Evernote, bir not tutma uygulamasıdır. Tutulan bu notlar tablet , bilgisayar ve mobil cihazlarla senkronize bir halde tutar. Aynı zamanda tutulan bu notlar başkaları ile de paylaşabilirsiniz. Eğer not defterizi paylaşırsanız ortak bir çalışma düzenleyebilirsiniz.
Evernote yardım sayfası için tıklayınız
Evernote eğitimde, ders notlarının paylaşılması , proje çalışmasında bulunan bilgilerin paylaşılması için kullanılabilir.
Dropbox, farklı cihazlar üzerine kurabileceğiniz bir uygulamadır. Bu uygulamanın ana işleviyse, işlem yaptığınız cihaz ( tablet, akıllı telefon, masaüstü, laptop) üzerinde oluşturduğunuz dosyalarındropbox klasörüne yüklendiği anda bulut sunucuyla eşlenmesidir yani aynı dosyaların başka bir sunucuya kopyalanmasıdır
Dropbox’ı en basit haliyle, bir dosya paylaşım platformu olarak tanımlayabiliriz. Yıllardır resim, müzik, döküman ya da sık kullandığımız diğer birçok dosyayı içinde depoladığımız flash diskin son ve en gelişmiş halidir Dropbox. Flash diskten farkıysa yanımızda taşımamızı ve unutmuş olma ihtimalinde kaygılanmamızı gerektirmez sadece bu uygulamadan faydalanabilmek için tek şart; online olmak.
2GB’ye kadar ücretsiz depolama alanı sunan Dropbox, istenildiğinde belli ücretler karşılığında kapasitesini 8GB’ye kadar arttırabiliyor.
Dropbox ana sayfasına gitmek için tıklayınız
Evernote eğitimde, ders notlarının paylaşılması , proje çalışmasında bulunan bilgilerin paylaşılması için kullanılabilir.
Dropbox
Dropbox, farklı cihazlar üzerine kurabileceğiniz bir uygulamadır. Bu uygulamanın ana işleviyse, işlem yaptığınız cihaz ( tablet, akıllı telefon, masaüstü, laptop) üzerinde oluşturduğunuz dosyalarındropbox klasörüne yüklendiği anda bulut sunucuyla eşlenmesidir yani aynı dosyaların başka bir sunucuya kopyalanmasıdır
Dropbox’ı en basit haliyle, bir dosya paylaşım platformu olarak tanımlayabiliriz. Yıllardır resim, müzik, döküman ya da sık kullandığımız diğer birçok dosyayı içinde depoladığımız flash diskin son ve en gelişmiş halidir Dropbox. Flash diskten farkıysa yanımızda taşımamızı ve unutmuş olma ihtimalinde kaygılanmamızı gerektirmez sadece bu uygulamadan faydalanabilmek için tek şart; online olmak.
2GB’ye kadar ücretsiz depolama alanı sunan Dropbox, istenildiğinde belli ücretler karşılığında kapasitesini 8GB’ye kadar arttırabiliyor.
Dropbox ana sayfasına gitmek için tıklayınız
Eğitim alanında Dropbox’u kullanarak çeşitli avantajlar elde edebiliriz. Örneğin hem okuldaki bilgisayarımızda hem de kişisel bilgisayarımızda Dropbox kurulu olursa bizim için gerekli olan belgeleri onun içerisine atarak her iki bilgisayarımızda da sorunsuzca kullanabiliriz. Böylece hem zamandan hem de iş yükünden kurtulmuş oluruz.
Kaynakça:
İTunes U
Karşınızda yeni iTunes U. Ödev teslimi, entegre edilmiş not defteri ve kişisel tartışmalar özellikleriyle sınıfınızı düzenlemenin sorunsuz bir yolu. Dersleri sunmanın, ödevlere not vermenin ve bağlantıda kalmanın ne kadar kolay olduğunu görün. Üstelik tümünü iPad’de yapabilirsiniz.
İTunes U kullanımı için tıklayınız
Eğitimde:
- Dersleri ve ödevleri hızlı bir şekilde oluşturmak için belge, çalışma sayfası, web bağlantısı, fotoğraf ve videoları Itunes U' ya aktarmak yeterli.
- Uygulamalar, kitaplar, videolar, podcast’ler ve iTunes’daki ana kaynaklar gibi zengin öğrenim materyalleri ile her öğrencinin katılımı sağlanabilir.
- Ödevler ITunes U ile öğrenciler tarafından kolayca teslim edilebilir ve öğretmenler de ödevleri kolayca okuyabilir.
- Herkesin katılabileceği tartışma ortamları yaratılabilir.
Kaynakça:
3 Aralık 2015 Perşembe
Arttırılmış Gerçeklik: Space Craft 3D, Anotomy 4D
ARTIRILMIŞ GERÇEKLİK (AR) NEDİR, NE İŞE YARAR, EĞİTİMDE NASIL KULLANILIR?
Spacecraft 3d nedir, ne işe yarar?
NASA'nın uzay aracı 3D hakkında bilgi ve bizim güneş sistemi, çalışma Dünyayı keşfetmek ve evreni gözlemlemek için kullanılan uzay aracı ile çeşitli etkileşim sağlayan bir artırılmış gerçeklik (AR) uygulamasıdır.
Spacecraft 3D adlı uygulama NASA altında faaliyet gösteren Jet Propulsion Laboratory tarafından geliştirildi. Uygulama, NASA'nın bugüne kadar geliştirdiği uzay araçlarını 3D animasyon olarak yakından tanıma fırsatı veriyor.
Hali hazırda Mars yolculuğuna çıkacak Curiosity ve GRAIL programında kullanılan Ebb and Flow adlı araçları animasyon olarak kullanıcılara tanıtılıyor. Artırılmış gerçeklik sayesinde uygulama, cihazın kamerasını kullanarak örneğin odanızdaki bir kağıt üzerinde bu araçların animasyonları oynatılıyor. Böylece sanki odanızda araçları inceliyormuşsunuz havası yaratılıyor.
Anotomy 4D nedir, ne işe yarar, eğitimde nasıl yararlanılır?
Eğitim ve arttırılmış gerçeklik uygulamalarını birleştiren bir uygulama olan 4D Anatomy uygulaması bir android uygulamasıdır. Android işletim sistemli tablet veya akıllı telefonunuza google playden öncelikle 4D Anatomy uygulamsını indirip kurun. Sonra aşağıda verdiğimiz resmi uygulamaya gösterin, isterseniz resmi yazıcıdan çıktı alarakra her yerde kullanabilirsiniz. uygulama çalışmaya başlayacak ve size insan vücudundaki her türlü sistemi gösterecek. Örneğin damarlar, üreme sistemi veya iskelet sistemi gibi.
Bu ücretsiz uygulama ve basit yazdırılan görüntünün sayesinde, Anatomi 4D öğrenciler, öğretmenler, tıp uzmanları ve insan anatomisinin bir interaktif 4D deneyimi içine vücuda hakkında bilgi edinmek isteyen herkes taşır. Görme çarpıcı ve tamamen interaktif, Anatomi 4D 21. yüzyıl eğitim için mükemmel bir araç yaratmak için genişletilmiş gerçeklik ve diğer son teknolojileri kullanır.
KAYNAKÇA:
Artırılmış
gerçeklik, gerçekte var olan bir
nesnenin üzerine, bilgisayar tarafından üretilmiş ses, görüntü ve GPS
verilerinin eklenmesi, böylece var olan içeriğin zenginleştirilerek sunulması
olarak tanımlanabilir. Örneğin 2 boyutlu olan kaynağınızı, bu teknoloji ile 3
boyutlu hale getirmek, ya da kağıt ortamındaki resim ve yazılarınızı
video haline dönüştürmek artık mümkün.
Eğitim hayatımızda da yavaş yavaş yerini almaya başlayan
“Artırılmış Gerçeklik” kavramı; öğretilmek istenen konunun daha etkileşimli,
öğrenme sürecine katkı sağlayan, kullanması kolay ve kullanıcı doyumunu
artıran öğrenme malzemeleri sunabilmesi açısından değerli. Bizler
eğitimin içinde arttırılmış gerçekliği pek çok yerde kullanabiliriz, bunun bir
sınırını koymak doğru değil. Sınıfımızda bir panoyu artırılmış gerçeklik
uygulamasıyla dijital hale getirebiliriz ya da hazırlamış olduğumuz bir
etkinliğin içindeki resme bir video yerleştirerek öğrencilerimize
sürprizler hazırlayabiliriz.
Spacecraft 3d nedir, ne işe yarar?
NASA'nın uzay aracı 3D hakkında bilgi ve bizim güneş sistemi, çalışma Dünyayı keşfetmek ve evreni gözlemlemek için kullanılan uzay aracı ile çeşitli etkileşim sağlayan bir artırılmış gerçeklik (AR) uygulamasıdır.
Spacecraft 3D adlı uygulama NASA altında faaliyet gösteren Jet Propulsion Laboratory tarafından geliştirildi. Uygulama, NASA'nın bugüne kadar geliştirdiği uzay araçlarını 3D animasyon olarak yakından tanıma fırsatı veriyor.
Hali hazırda Mars yolculuğuna çıkacak Curiosity ve GRAIL programında kullanılan Ebb and Flow adlı araçları animasyon olarak kullanıcılara tanıtılıyor. Artırılmış gerçeklik sayesinde uygulama, cihazın kamerasını kullanarak örneğin odanızdaki bir kağıt üzerinde bu araçların animasyonları oynatılıyor. Böylece sanki odanızda araçları inceliyormuşsunuz havası yaratılıyor.
Anotomy 4D nedir, ne işe yarar, eğitimde nasıl yararlanılır?
Eğitim ve arttırılmış gerçeklik uygulamalarını birleştiren bir uygulama olan 4D Anatomy uygulaması bir android uygulamasıdır. Android işletim sistemli tablet veya akıllı telefonunuza google playden öncelikle 4D Anatomy uygulamsını indirip kurun. Sonra aşağıda verdiğimiz resmi uygulamaya gösterin, isterseniz resmi yazıcıdan çıktı alarakra her yerde kullanabilirsiniz. uygulama çalışmaya başlayacak ve size insan vücudundaki her türlü sistemi gösterecek. Örneğin damarlar, üreme sistemi veya iskelet sistemi gibi.
Bu ücretsiz uygulama ve basit yazdırılan görüntünün sayesinde, Anatomi 4D öğrenciler, öğretmenler, tıp uzmanları ve insan anatomisinin bir interaktif 4D deneyimi içine vücuda hakkında bilgi edinmek isteyen herkes taşır. Görme çarpıcı ve tamamen interaktif, Anatomi 4D 21. yüzyıl eğitim için mükemmel bir araç yaratmak için genişletilmiş gerçeklik ve diğer son teknolojileri kullanır.
Yani çok fazla bir uygulama daha, Anatomi 4D deneyimi bizim organları, iskelet, kaslar ve vücut sistemlerinin mekansal ilişkileri ortaya, insan vücudunun ve kalbin içinde bir yolculuğa izleyiciler alır. Bu basit kullanımlı 3-boyutlu bir öğrenme ortamı her zaman sınıfta ya da kullanım için mükemmeldir.
DAQRI tarafından tasarlanan, Anatomi 4D uygulaması size sağlar:
• hakkında bilgi edinin ve karmaşık ayrıntılı insan vücudu ve kalbi keşfetmek
Örneğin, sadece iskelet, kas, ya da solunum sistemini odaklanmak böylece •, bireysel çeşitli organ sistemlerini vurgulayın
• ileri geri bir erkek ve kadın bedeni arasındaki görünümünü değiştirme
• derinlemesine her organ veya vücut parçası yaşamaya yakınlaştırma
• Yeni kalp hedef de dahil olmak üzere yeni görüntü hedefleri kullanın (bu yeni uygulama sürümü hala orijinal görüntü hedef destekler)
• İnsan anatomisi hakkında ilham alın!
• hakkında bilgi edinin ve karmaşık ayrıntılı insan vücudu ve kalbi keşfetmek
Örneğin, sadece iskelet, kas, ya da solunum sistemini odaklanmak böylece •, bireysel çeşitli organ sistemlerini vurgulayın
• ileri geri bir erkek ve kadın bedeni arasındaki görünümünü değiştirme
• derinlemesine her organ veya vücut parçası yaşamaya yakınlaştırma
• Yeni kalp hedef de dahil olmak üzere yeni görüntü hedefleri kullanın (bu yeni uygulama sürümü hala orijinal görüntü hedef destekler)
• İnsan anatomisi hakkında ilham alın!
KAYNAKÇA:
27 Kasım 2015 Cuma
25 Kasım 2015 Çarşamba
18 Kasım 2015 Çarşamba
17 Kasım 2015 Salı
16 Kasım 2015 Pazartesi
Çengel bulmaca
SOLDAN SAĞA
2-Periyodik tablo dikey sütunları
3-8A grubu elementleri adı
5-Maddenin en küçük yapı birimi
8-4A,5A,6A ve 7A grubu elementleri
10-1A,2A,3A ve B grubu elementleri
11-Mavi turnusol kağıdın kırmızıya çevirir
YUKARIDAN AŞAĞIYA
1-Periyodik tablo yatay sıralar
4-İki ya da daha fazla cinste atomun bir araya gelerek
oluşturduğu saf maddeler
6-Boşlukta yer kaplayan, kütlesi ve eylemsizliği olan her
şey
7-Aynı cins atomlardan meydana gelen saf maddeler
9-Kırmızı turnusol kağıdını maviye çevirir
ÇENGEL BULMACA PDF HALİ İÇİN TIKLAYINIZ.
ÇENGEL BULMACANIN CEVAPLARI
15 Kasım 2015 Pazar
8. SINIF MADDENİN YAPISI VE ÖZELLİKLERİ KONU ANLATIMI
pdf halinde indirmek için tıklayınız.
PERİYODİK TABLO
Maddenin
temel birimi atomlar. Tek bir cins atomdan oluşmuş, kimyasal tekniklerle
ayrıştırılamayan ya da farklı maddelere dönüştürülemeyen saf maddelereyse "element"
adı veriliyor. Dünya üzerinde bilinen elementlerin belirli bir şekilde
yerleştirildiği sistem, periyodik tablo olarak adlandırılıyor.
Elementlerin,
soldan sağa ve yukarıdan aşağıya doğru artan atom numaralarına göre
diziliminden oluşan bu tabloda, yatay sıralara "periyot",
dikey sütunlaraysa "grup" adı veriliyor.

1s2 / 2s2 2p6 / 3s2 3p6 / 4s2 3d10 4p6
s ve p A gurubu elementlerini d B gurubu elementlerini
gösterir.
Periyodik
tabloyu kullanarak, her element hakkında belirli bilgiler elde edebiliriz.
Atom
Numarası: Bir atomda
bulunan proton sayısı, elementi tanımlar ve atom numarası olarak adlandırılır.
Atomda bulunan proton sayısı aynı zamanda, elementin kimyasal karakteri
hakkında da bilgi verir.
Element
Simgesi: Her elemente ait bir ya da iki
harften oluşan simgelerin, uluslararası geçerliliği vardır.
Elektron Dizilimi: Uyarılmamış bir atomdaki elektronların konumlarını gösterir. Kimya bilimciler, temel fizik bilgilerine dayanarak, atomların elektron dizilimlerine göre nasıl davranabilecekleri konusunda fikir yürütebilirler. Bir elementin periyodik tablodaki yerine bakarak, o elementin elektron dizilimi de anlaşılabilir. Aynı grupta (dikey sırada) yer alan elementlerin elektron dizilimleri büyük benzerlik gösterir ve bu nedenle de kimyasal tepkimelerde benzer şekilde davranırlar. Yükseltgenme basamağı (sayısı): Bir elementin, bileşiklerinde alabileceği değerliklerdir. İngilizce'deki "oxidation state" kullanımına karşılık gelmektedir. Periyodik tabloda yer alan elementler, gösterdikleri belirli ortak özelliklere göre gruplar halinde inceleniyor. Bu gruplar hakkında kısaca bilgi vermek gerekirse:
Elektron Dizilimi: Uyarılmamış bir atomdaki elektronların konumlarını gösterir. Kimya bilimciler, temel fizik bilgilerine dayanarak, atomların elektron dizilimlerine göre nasıl davranabilecekleri konusunda fikir yürütebilirler. Bir elementin periyodik tablodaki yerine bakarak, o elementin elektron dizilimi de anlaşılabilir. Aynı grupta (dikey sırada) yer alan elementlerin elektron dizilimleri büyük benzerlik gösterir ve bu nedenle de kimyasal tepkimelerde benzer şekilde davranırlar. Yükseltgenme basamağı (sayısı): Bir elementin, bileşiklerinde alabileceği değerliklerdir. İngilizce'deki "oxidation state" kullanımına karşılık gelmektedir. Periyodik tabloda yer alan elementler, gösterdikleri belirli ortak özelliklere göre gruplar halinde inceleniyor. Bu gruplar hakkında kısaca bilgi vermek gerekirse:
Alkali
Metaller: Periyodik tablonun ilk grubunda 1A
(dikey sırasında) yer alan metallerdir. Fransiyum dışında hepsi, yumuşak yapıda
ve parlak görünümdedir. Kolaylıkla eriyebilir ve uçucu hale geçebilirler. Bağıl
atom kütleleri arttıkça, erime ve kaynama noktaları da düşüş gösterir. Diğer
metallere kıyasla, özkütleleri de oldukça düşüktür. Hepsi de, tepkimelerde
etkindir. En yüksek temel enerji düzeylerinde bir tek elektron taşırlar. Bu
elektronu çok kolay kaybederek +1 yüklü iyonlar oluşturabildikleri için,
kuvvetli indirgendirler. Isı ve elektriği çok iyi iletirler. Suyla
etkileşimleri çok güçlüdür, suyla tepkime sonucunda hidrojen gazı açığa
çıkarırlar.
Toprak
Alkali Metaller: Periyodik
tablonun baştan ikinci grubunda 2A (dikey sırasında) yer alan
elementlerdir. Sıklıkla beyaz renkli olup, yumuşak ve işlenebilir yapıdadırlar.
Alkali metallerden daha az tepken (tepkimelere girmeye eğilimli) karakterde
olmalarının yanında, erime ve kaynama sıcaklıkları da daha düşüktür. İyonlaşma
enerjileri de alkali metallerden daha yüksektir. Toprak elementleri ismi, bu
gruptaki elementlerin toprakta bulunan oksitlerinin, eski kimya bilimciler
tarafından ayrı birer element olarak düşünülmesinden gelir.
Geçiş
metalleri:B gurubu Sertlikleri, yüksek yoğunlukları,
iyi ısı iletkenlikleri ve yüksek erime-kaynama sıcaklıklarıyla tanınırlar.
Özellikle sertlikleri nedeniyle, saf halde ya da alaşım halinde yapı malzemesi
olarak kullanılırlar. Geçiş elementlerinin hepsi, elektron dizilimlerinde, en
dışta her zaman d orbitalinde elektron taşırlar. Tepkimelere giren elektronlar
da, d orbitalindeki elektronlardır. Geçiş metalleri sıklıkla birden fazla
yükseltgenme basamağına sahiptir. Çoğu, asit çözeltilerinde hidrojenle yer
değiştirecek kadar elektropozitiftir. İyonları renkli olduğu için, analizlerde
kolay ayırt edilirler.
Ametaller: Metal özelliği göstermeyen
elementlerdir. Metaller çözeltilerde katyonları (pozitif yüklü iyonları)
oluştururken, ametaller anyon (negatif yüklü iyon) oluşturma eğilimindedir.
Metallerin aksine iyi iletken değillerdir ve elektronegatiflikleri çok
yüksektir. Metaller ve ametaller arasında özellikler gösteren bazı yarıiletken
elementler, "metaloidler" olarak da adlandırılır. Halojenler ve
soygazlar da ametal doğadadır.
Halojenler: Periyodik tablonun 7A
grubunda bulunan, tepkimeye eğilimli ametallerdir. Bu gruptaki elementlerin
hepsi elektronegatiftir. Elektron alma eğilimi en yüksek olan elementlerdir.
Doğada sert olarak değil, mineraller halinde bulunurlar. Element halinde 2 atomlu
moleküllerden oluşurlar. Oda koşullarında flor ve klor gaz, brom sıvı, iyotsa
katı haldedir. Erime ve kaynama noktaları grupta aşağıdan yukarıya doğru
azalır. Zehirli ve tehlikeli elementler olarak bilinirler.
Soygazlar: Periyodik tablonun en son 8A grubunu oluşturan,
tümü tek atomlu ve renksiz gaz halinde bulunan elementlerdir. En dış
yörüngeleri elektronlarla tamamen dolu olduğu için son derece kararlıdırlar ve
tepkimelere eğilimleri de çok düşüktür. Bu davranışları nedeniyle de
"soygaz" adını almışlardır. Atmosferde bulunurlar ve sıvı havanın
damıtılmasıyla elde edilirler. İlk keşfedilen soygaz, hidrojenden sonra en
hafif element olan helyumdur. Radon, çekirdeği dayanıksız olan, radyoaktif bir
elementtir. Çok düşük olan erime ve kaynama noktaları, grupta yukarıdan aşağıya
gidildikçe yükselir. İyonlaşma enerjileri, sıralarında en yüksek olan
elementlerdi
Elementlerin atom numaralarına göre belirli bir kurala uyarak sıralanması ile periyodik cetvel oluşur.
Elementlerin atom numaralarına göre belirli bir kurala uyarak sıralanması ile periyodik cetvel oluşur.
- Periyodik cetvelde yatay sıralara periyot, düşey sıralara grup denir. Periyodik cetvelde 7 tane periyot, 8 tane A grubu, 8 tane B grubu vardır. 8B grubu 3 tanedir. Her periyot kendine ait olan s orbitali ile başlar p orbitali ile biter. Diger bir ifade ile 1A grubu ile başlayıp 8A grubu ile sona erer.
- Periyodik cetvelde A grubu elementlerinin özel isimleri vardır.
1A-ALKALİ METALLER
2A-TOPRAK ALKALİ METALLER
3A-TOPRAK METALLER
4A-KARBON GRUBU
5A-AZOT GRUBU
6A-OKSİJEN GRUBU
7A-HALOJENLER
8A-SOYGAZLAR
- Periyodik cetvelde aynı grupta bulunan elementlerin değerlik elektron sayıları aynı olduğundan benzer kimyasal özellik gösterirler.
METAL-AMETAL ve SOYGAZ’IN ÖZELLİKLERİ
|
||
Metal
|
Ametal
|
Soygaz
|
Grup numarası 1A,2A, 3A, ve B gruplarında bulunan elementler metaldir.
Kendilerini soygaza benzetmek için son yörüngelerindeki elektoronları
vererek
(+)değerlik alırlar. 1A(+1), 2A (+2)Kesinlikle (-) değer almazlar.
Kendi aralarında bileşik oluşturmazlar.Ametallerle bileşik oluştururlar.
İndirgen özellik gösterirler.
Tel ve Levha haline gelebilirler.
Elektrik akımını iletirler.
Tabiatta genellikle katı halde bulunurlar .
|
Grup numarası 5A ,6A,7A, olanlar ametaldir.
Soygaza benzeme yani son yörüngelerindeki elektronları 8′e tamamlamak
için elektron alarak(-) değerlik alılar.
5A(-3),6A,(-2)7A(-1)…
Fakat(+) değerlik alabilirler.
Kendi aralarında ve metallerle bileşik oluştururlar.
Yükseltgen özellik gösterirler.
Tel ve levha haline gelmezler.
Elektrik akımını iletmezler.
Tabiatta genelde gaz ve çift atomlu moleküller halinde bulunurlar. (F2,N2,02…)
|
Grup Numarası 8A olanlar soygazdır.
Kararlıdırlar,elektron alış-verişi yapmazlar.
Bileşik yapmazlar
Orbitalleri doludur.
Tabiatta tek atomlu gaz halinde bulunurlar.
|
BİLEŞİK OLUŞUMU
a. Metal +
Ametal →İYONİK
b. Ametal +
Ametal→KOVALENT
Metaller son
yörüngelerindeki elektronları vererek (+) değerlik alırlar.
Ametaller
ise son yörüngedeki elektronları 8′e tamamlamak için elektron alarak (-)
değerlikli olurlar.
Bileşik
formülünü bulabilmek için öncelikle bileşiği oluşturacak elementlerin
değerlikleri tespit edilir. Bu değerlikler en küçük katsayılar şeklinde
çaprazlanır.
En genel
ifadesi ile X+m ile Y-n iyonu XnYm
bileşiğini
oluşturur.
Bileşiği
oluşturan atomların her ikisi de ametal olduğunda farklı bileşik formülleri
oluşabilir.
KİMYASAL BAĞLAR
 Doğada elementleri tek başlarına bulmak neredeyse imkansızdır. Çoğu
element başka bir elementle birleşerek kimyasal bağ yapar.
Doğada elementleri tek başlarına bulmak neredeyse imkansızdır. Çoğu
element başka bir elementle birleşerek kimyasal bağ yapar.Elementlerin son katmanlarını dolu hale getirmek isterler. Örneğin 1 elektronu bulunan hidrojen tek katmana sahiptir ve o katmanın dolması için toplam 2 elektron olmalıdır.
Bu nedenle
hidrojen ihtiyaç duyduğu 1 elektronu başka bir elementle bağ yaparak sağlamak
ister.
Hidrojenin
bu çağrısı doğada asla cevapsız kalmaz. Hidrojen atomları başka elementlerle
birleşerek, yani bağ yaparak elektron ihtiyaçlarını tamamlarlar.
Biz bu
konumuzda gerçekleşen kimyasal bağların özelliklerinin neler olduğunu, hangi
tip kimyasal bağların gerçekleştiğini açıklamaya çalışacağız.
1. İyonik Bağ
İyonik
Bağ Nasıl Oluşur?
Atomlar son
katmanlarını doldurmak isterler. Buna atomların kararlı hale geçmek istemesi de
denir.
Bazı atomların son katmanlarında eksik elektron, bazı atomlarda da fazladan elektron bulunur.

Yukarıdaki örnekte sodyumun(Na) son katmanında 8 olması gerekirken 1 elektronu var. Bu elektron fazlalık sayılır. Çünkü 1 elektronu dışarı verirse geriye tam dolu olan 2. katmanı kalır.
Flor(F) atomunda ise kon katmanda 8 olması gereken elektron sayısı 7 dir. Yani 1 elektrona daha ihtiyacı vardır.
Bazı atomların son katmanlarında eksik elektron, bazı atomlarda da fazladan elektron bulunur.

Yukarıdaki örnekte sodyumun(Na) son katmanında 8 olması gerekirken 1 elektronu var. Bu elektron fazlalık sayılır. Çünkü 1 elektronu dışarı verirse geriye tam dolu olan 2. katmanı kalır.
Flor(F) atomunda ise kon katmanda 8 olması gereken elektron sayısı 7 dir. Yani 1 elektrona daha ihtiyacı vardır.
Dikkat
edersek Sodyum 1 elektrondan kurtulmak istiyor, Flor ise 1 elektron arıyor.


Sodyum
fazlalık elektronu Flora verir.
Elektron veren sodyum artı (+) ; elektron alan flor eksi (-) yüklenir.
+ ve – birbirini çektiği için iki atom birbirine yapışır.
Bu sayede Flor ve Sodyum atomları arasında kimyasal bağ oluşur.
Elektron veren sodyum artı (+) ; elektron alan flor eksi (-) yüklenir.
+ ve – birbirini çektiği için iki atom birbirine yapışır.
Bu sayede Flor ve Sodyum atomları arasında kimyasal bağ oluşur.
Aşağıda
iyonik bağ animasyon halinde aşamalı olarak gösterilmiştir. Dikkatle
inceleyelim:

İyonik
Bağ Kimler Arasında Oluşur?
- Metallerle ametaller arasında oluşur.
- + yüklü atomlarla – yüklü atomlar arasında oluşur.
- Anyon ve katyonlar arasında oluşur.
- Elektron alanlarla elektron verenler arasında oluşur.
- Son katmanında elektron fazlası olanlarla elektron eksiği olanlar arasında oluşur.
- Elektron alışverişi gerçekleşir.
İyonik bağ
sadece iki atom arasında gerçekleşmez.
Bazen elektron alışverişini tamamlamak için ikiden fazla atoma ihtiyaç duyulur.
Aşağıdaki örneği inceleyelim:
Bazen elektron alışverişini tamamlamak için ikiden fazla atoma ihtiyaç duyulur.
Aşağıdaki örneği inceleyelim:

Yukarıdaki
örneğe bakarsak, bir tane kalsiyum atomunun ihtiyacını ancak 2 tane klor
giderebilmektedir.
Kalsiyumun 2 fazlalık elektronu, klorun da bir eksik elektronu bulunur. Kalsiyum fazlalık elektronlarını iki klor atomuna paylaştırır.
Bu nedenle bu üç atam arasında iyonik bağ oluşur. Oluşan bileşikte 1 tane kalsiyum, 2 tane klor atomu bulunur.
Kalsiyumun 2 fazlalık elektronu, klorun da bir eksik elektronu bulunur. Kalsiyum fazlalık elektronlarını iki klor atomuna paylaştırır.
Bu nedenle bu üç atam arasında iyonik bağ oluşur. Oluşan bileşikte 1 tane kalsiyum, 2 tane klor atomu bulunur.
İyonik bağ
metal elementlerle ametal elementler arasında gerçekleşir. Bir atomun elektronu
fazla, diğerinin az olması durumunda gerçekleşen iyonik bağda fazla elektronu
olan az olana elektron verir. Bu sayede atomlar + ve – yüklerle yüklenirler.
Metaller + yüklü, ametaller ise – yüklüdür. Daha doğrusu metaller elektron verdikleri için +, ametallerde elektron aldıkları için olurlar.
Metaller + yüklü, ametaller ise – yüklüdür. Daha doğrusu metaller elektron verdikleri için +, ametallerde elektron aldıkları için olurlar.

Resimde elektron dağılımı verilen sodyum(Na) ve flor (F) atomlarının elektronlarının sayısı konusunda sıkıntıları vardır. 2 atomun da son yörüngeleri tam dolu değildir.
Sodyum: Ya 7 elektron alarak son yörüngesini 8′e tamamlamalı ya da son yörüngesindeki 1 elektronu atarak 2 yörüngeli hale gelmelidir. 7 elektron almaktansa 1 elektron vermek kolay olduğu için sodyum 1 elektronunu flora verir.
Flor: Ya 7 elektron vererek tek yörüngeli hale gelmeli, ya da 1 elektron alarak son yörüngesini 8′e tamamlamalıdır. Florun 1 elektron alması 7 elektron vermesinden daha kolaydır. Bu nedenle flor sodyumdan 1 elektron alır.
Atomlar elektron alışverişi yaparak bağ oluşturduklarında Kararlı Hale Geçmiş olurlar. Atomların bileşik yapmış hali aşağıdaki gibidir.

Elektron alışverişi yapılarak gerçekleşen bu iyonik bağda NaF bileşiği oluşmuştur. Na + yüklü ve metal; F ise – yüklü ve ametaldir.
2. Kovalent Bağ
Bazen
atomların elektron alışverişi yapmak işlerine gelmez. Bunu
şöyle düşünelim.

İki atom
olsun ikisinin de elektron ihtiyacı olsun. Kimse diğerine elektron vermek
istemez.
Böyle bir
durumda atomların birbirine destek olması gerekmez mi? Evet iki atom
birbirlerine destek olurlar ve elektronlarını ortaklaşa kullanarak
ihtiyaçlarını giderirler.
Kovalent bağ
ametallerin kendi aralarında yaptığı kimyasal bağdır. Elektronların ortaklaşa
kullanılmasıyla olur.

Bu bileşikte
mavi renkle gösterilen elektronlar ortaklaşa kullanılır. Bu sayede Hidrojen son
yörüngesini 2 ye tamamlayarak doldurur. Klor ise yine son yörüngesini 8′e
tamamlayarak kararlı hale geçmiş olur.
Hangi
atomlar kovalent bağ yapar?
Elektron eksiği bulunan atomların yaptığı kimyasal bağa KOVALENT BAĞ denir.
Elektron eksiği bulunan atomların yaptığı kimyasal bağa KOVALENT BAĞ denir.
Kovalent Bağ Çeşitleri
Tekli kovalent bağ
Ortaklaşa kullanılan elektronlar bir çifttir.

Hidrojenin tek katmanı vardır. Bu katmanda da sadece 1 elektronu bulunur.
Atomların 1. karmanı en fazla 2 elektron alabilir. Yani hidrojenin 1 elektrona daha ihtiyacı vardır.
Kendisi gibi başka bir hidrojen atomu bularak birer elektronlarını ortaklaşa kullanırlar. Böylece ikisinin de 2 tane elektronu varmış gibi olur.
Ortaklaşa kullanılan elektronlar bir çifttir.

Hidrojenin tek katmanı vardır. Bu katmanda da sadece 1 elektronu bulunur.
Atomların 1. karmanı en fazla 2 elektron alabilir. Yani hidrojenin 1 elektrona daha ihtiyacı vardır.
Kendisi gibi başka bir hidrojen atomu bularak birer elektronlarını ortaklaşa kullanırlar. Böylece ikisinin de 2 tane elektronu varmış gibi olur.
İkili Kovalent Bağ
Ortaklaşa kullanılan elektronlar iki çifttir.

Yukarıdaki atomların son katmanlarında 6 elektronları vardır. Yani 2 elektron daha aramaktadırlar.
İkişer elektronlarını ortaklaşa kullanarak kararlı yapıya geçerler.
Üçlü
kovalent bağ
Üç çift elektron ortaklaşa kullanılır.

Bu atomların son katmanlarında 5 elektronları var. Kararlı olmaları için 8 olması gerekir.
başka bir atomla üçer elektronu ortak kullanarak kararlı hale geçebilirler.
Üç çift elektron ortaklaşa kullanılır.

Bu atomların son katmanlarında 5 elektronları var. Kararlı olmaları için 8 olması gerekir.
başka bir atomla üçer elektronu ortak kullanarak kararlı hale geçebilirler.
Polar
ve Apolar Kovalent Bağ
Polar kelimesi “kutuplu” anlamına gelmektedir.
Polar kelimesi “kutuplu” anlamına gelmektedir.
Polar
Kovalent Bağ
Eğer kovalent bağ yapan atomlar farklı atomlarsa polar kovalent bağ adı verilir

Eğer kovalent bağ yapan atomlar farklı atomlarsa polar kovalent bağ adı verilir

Apolar
Kovalent Bağ
Kovalent bağı oluşturan atomlar aynı türse polar kovalent bağ oluşur.

Kovalent bağı oluşturan atomlar aynı türse polar kovalent bağ oluşur.

Kovalent
Bağın Özellikleri
- Ametallerin kendi aralarında yaptığı bağ çeşididir.
- Elektron ihtiyacı olan atomlar arasında gerçekleşir.
- - yüklü atomlar arasında gerçekleşebilir.
- Polar ve apolar olanları vardır.
- Aynı cins atomlar arasında gerçekleşebilir.
- Elektronlar ortaklaşa kullanılır.
KİMYASAL TEPKİMELER
Kimyasal değişim: maddenin
içyapısında meydana gelen değişimlerdir. Kırılganlık, esneklik, sağlamlık,
saydam olma, suda çözünme veya çözünmeme gibi özellikler maddenin kimlik
özellikleri olarak tanımlanır. Kimyasal değişimler sonucu bu özellikler
değişir. Örneğin kâğıdın yanması, elmanın çürümesi, ekmeğin küflenmesi, su
oluşumu gibi. Çökelek oluşumu, gaz çıkışı, renk değişimi, sıcaklık değişimi
kimyasal değişimleri fark etmenin yoludur.
Kimyasal tepkime:
maddedeki kimyasal değişim süreci, kimyasal tepkime olarak adlandırılır.
·
Kimyasal Tepkimeler: Fiziksel değişimlerde maddenin dış
görünüşü değişirken kimyasal değişimlerde maddenin içyapısı ve dış yapısı
görünüşü değişir.
·
Bir kâğıt parçasını yırtarsak dış görünüşü değişir ama kağıtlığından bir
şey kaybetmez. Oysa kâğıdı yaktığımızda CO2 ve kül denilen yeni
maddeler ortaya çıkar. Bu durumda kâğıdın yırtılması fiziksel değişime,
yakılması kimyasal değişime örnektir.
·
Bir
ekmeği dilimlediğimizde dış görünümü değişir ama içyapısı değişmez. Yani
fiziksel değişim geçirmiştir. Ekmeği nemli ortamda birkaç gün tuttuğumuzda
küflenir ve kimyasal değişim geçirir. Örneklerde olduğu gibi kimyasal değişimin
olduğu yerde fiziksel değişim de vardır.
·
Fiziksel
değişimlerde maddeyi oluşturan tanecikler arasındaki mesafe değişmektedir,
hâlbuki kimyasal değişimlerde maddeler arsı bağlar kırılıp yerine başka
maddelerle bağlar oluşmaktadır.
·
Hidrojen
ve oksijen gaz halindedir. Bu maddelerin oluştuğu su sıvı haldedir.

·
Hidrojen
gazı yanıcı bir madde, oksijen gazı yakıcı bir maddedir. Bu maddelerin oluşturduğu
H2O söndürücü bir maddedir. Madde kimyasal değişim geçirdiği için
özellikleri değişmiştir.
·
Kimyasal
tepkimelerde maddelerin atom sayısı ve cinsi değişmez. Bunun için toplam
kütlede değişmez.

a) Bir maddenin farklı maddelere ayrışmasına ya da farklı maddelerin
etkileşerek yeni maddeler oluşturmasına kimyasal tepkime (reaksiyon) denir.
b) Kimyasal tepkimeler, olaya giren maddelere ait taneciklerin (molekül, atom ya da iyon) çarpışmaları ile gerçekleşirler.Enerjileri yeterli olan taneciklerin çarpışmaları sonucunda kimyasal bağlar koparak moleküller atomlarına dağılır ve atomlar yeniden düzenlenerek farklı maddeler oluştururlar.Kimyasal tepkime, kimyasal değişim ve kimyasal olay eş anlamlıdır.Tepkimelerin sembol ve formüllerle gösterilmesine ise tepkime denklemleri adı verilir.
Örn; Karbon + Oksijen ------< Karbondioksit tepkimesi
C + O2 ------> CO2 şeklinde gösterilir.
c) Yanma, paslanma (oksitlenme), nötürleşme, mayalanma, fotosentez, çökelme gibi olaylar kimyasal değişime örnek olarak verilebilir.
d) Kimyasal bir tepkimede;
Korunan nicelikler şunlardır
b) Kimyasal tepkimeler, olaya giren maddelere ait taneciklerin (molekül, atom ya da iyon) çarpışmaları ile gerçekleşirler.Enerjileri yeterli olan taneciklerin çarpışmaları sonucunda kimyasal bağlar koparak moleküller atomlarına dağılır ve atomlar yeniden düzenlenerek farklı maddeler oluştururlar.Kimyasal tepkime, kimyasal değişim ve kimyasal olay eş anlamlıdır.Tepkimelerin sembol ve formüllerle gösterilmesine ise tepkime denklemleri adı verilir.
Örn; Karbon + Oksijen ------< Karbondioksit tepkimesi
C + O2 ------> CO2 şeklinde gösterilir.
c) Yanma, paslanma (oksitlenme), nötürleşme, mayalanma, fotosentez, çökelme gibi olaylar kimyasal değişime örnek olarak verilebilir.
d) Kimyasal bir tepkimede;
Korunan nicelikler şunlardır
·
- Atomların türü ve sayısı
- Toplam kütle (Kütle değişimi önemsizidir.)
- Toplam elektriksel yük
- Toplam enerji
- Atomların çekirdek yapıları (Proton ve nötron sayıları)
- Toplam kütle (Kütle değişimi önemsizidir.)
- Toplam elektriksel yük
- Toplam enerji
- Atomların çekirdek yapıları (Proton ve nötron sayıları)
·
Kütle : 128gr.
32gr. 160gr.
Korunur
Mol sayısı : 2 1 2 Korunmaz
Mol atom sayısı : 6 2 8 Korunur
Mol sayısı : 2 1 2 Korunmaz
Mol atom sayısı : 6 2 8 Korunur
Tepkime Denkleminin Yazılması
• Önce tepkimeye giren daha sonra tepkime sonunda oluşan maddelerin kimyasal formülleri yazılır. Tepkime sonunda oluşan yeni maddeler ürün olarak adlandırılır.
• Giren maddelerin hangi ürünleri oluşturduğunu ifade etmek amacıyla ok işareti ( à) kullanılır.
• Kimyasal denklemde tepkimeye giren maddeler okun sol tarafına, ürünler ise sağ tarafına yazılır.
• Kimyasal tepkimeye giren maddeler ve ürünler birden fazla ise aralarında "+" işareti kullanılır.
• Giren maddeler arasındaki "+" işareti bu maddelerin birbiriyle tepkimeye girdiği; ürünler arasındaki "+" işareti ise bu maddelerin tepkime sonucunda oluştuğu anlamına gelir.
• Kimyasal tepkime denklemi yazılırken maddeyi oluşturan en küçük birim (atom, molekül veya iyon) esas alınır.
• Örneğin; oksijen elementi moleküllü yapıya sahip olduğu için denklemde "O“ şeklinde ifade edilmez, "O2" şeklinde gösterilir.
• Kimyasal tepkimelerde;
-Atom sayısı,
-Atom çeşidi,
- Toplam kütle, DEĞİŞMEZ.
• Önce tepkimeye giren daha sonra tepkime sonunda oluşan maddelerin kimyasal formülleri yazılır. Tepkime sonunda oluşan yeni maddeler ürün olarak adlandırılır.
• Giren maddelerin hangi ürünleri oluşturduğunu ifade etmek amacıyla ok işareti ( à) kullanılır.
• Kimyasal denklemde tepkimeye giren maddeler okun sol tarafına, ürünler ise sağ tarafına yazılır.
• Kimyasal tepkimeye giren maddeler ve ürünler birden fazla ise aralarında "+" işareti kullanılır.
• Giren maddeler arasındaki "+" işareti bu maddelerin birbiriyle tepkimeye girdiği; ürünler arasındaki "+" işareti ise bu maddelerin tepkime sonucunda oluştuğu anlamına gelir.
• Kimyasal tepkime denklemi yazılırken maddeyi oluşturan en küçük birim (atom, molekül veya iyon) esas alınır.
• Örneğin; oksijen elementi moleküllü yapıya sahip olduğu için denklemde "O“ şeklinde ifade edilmez, "O2" şeklinde gösterilir.
• Kimyasal tepkimelerde;
-Atom sayısı,
-Atom çeşidi,
- Toplam kütle, DEĞİŞMEZ.
Kimyasal tepkime türleri
A-Yanma tepkimeleri:
Bir maddenin
oksijen ile tepkimeye girerek yeni madde veya maddeler oluşması olayına denir.
Örneğin gümüşün kararması, magnezyumun yanması, metanın yanması.
Hidrojen yanıcı bir gaz oksijen yakıcı bir gazdır bu
iki gaz tepkime verdiğinde ortaya söndürücü olan bir sıvı olan su çıkar.
Yanma tepkimelerinin formüllerle
gösterimi:
v 4Ag+O2
® 2Ag2O
v 2Mg+O2 ® 2MgO
v CH4+2O2 ® CO2+2H2O+ısı
Yanma olayının gerçekleşebilmesi için
ortamda;
1- Yanıcı madde
2-Oksijen(yakıcı madde)
3-Yeterli sıcaklık
B-Asit-baz
tepkimeleri:
Asitler;
mavi turnusol kağıdın kırmızıya çevirir, tatları
ekşidir, cilde yanma hissi verir, fenolftalein damlatıldığında renk
değiştirmezler. Örneğin: H2SO4, HCl, sirke, limon gibi.
Bazlar
ise; kırmızı
turnusol kağıdını maviye çevirir, tatları acıdır, cilde kayganlık hissi
uyandırır, fenolftalein damlatıldığında renk değişimi gözlemlenir.
Örneğin: NaOH,KOH,karbonat
Asit ve baz çözeltileri birbirleriyle tepkimeye
girerek tuz oluşturur. Nötralleşme tepkimesi olarak adlandırılır.
Örnekleri:
Ø HCl+NaOH®NaCl+H2O(tuz
olarak sadece yemek tuzu olarak bilinen NaCl yoktur. Farklı asit ve bazların
tepkimelerinden farklı tuzlar oluşur.)
Ø NH3+HCl®NH4Cl
Ø HNO3+KOH
®KNO3+H2O
Asitler ve Bazlar
1. Suda
çözündüklerinde iyon oluştururlar. Bu nedenle asitlerin sulu çözeltileri az ya
da çok elektrik akımını iletir.
2.Tatları ekşidir. Limonun ekşiliği içindeki sitrik asitten, sirkenin ekşiliği içindeki asetik asitten ileri gelir.
3-Boya maddelerine etki ederler. Örneğin; turnusol boyasının rengini kırmızıya dönüştürürken, fenolftalein boyasını renksizleştirirler.
4. Aktif metallerle tepkimeye girerek hidrojen gazı oluştururlar.
5-Bu tepkimeyi alkali ve toprak alkali metallerin tümü ile Fe, Zn ve Al gibi soy olmayan metaller verir.
2.Tatları ekşidir. Limonun ekşiliği içindeki sitrik asitten, sirkenin ekşiliği içindeki asetik asitten ileri gelir.
3-Boya maddelerine etki ederler. Örneğin; turnusol boyasının rengini kırmızıya dönüştürürken, fenolftalein boyasını renksizleştirirler.
4. Aktif metallerle tepkimeye girerek hidrojen gazı oluştururlar.
5-Bu tepkimeyi alkali ve toprak alkali metallerin tümü ile Fe, Zn ve Al gibi soy olmayan metaller verir.
6-Cu, Hg ve
Ag gibi yarı soy metallere yapısında oksijen bulunmayan HCl, HBr gibi asitler
etki etmez. Bu metallere HNO3 ve H2SO4 gibi kuvvetli asitler etki eder. Ancak
bu tepkimelerde asitler asit olarak değil yükseltgen olarak etki eder. Yani bu
tepkimelerde H2 gazı değil H2O oluşur. Au ve Pt gibi soy metallere asitlerin
hiçbiri yalnız başına etki edemez.
7. Karbonat ve bikarbonatlarla tepkimeye girerek CO2 gazı oluştururlar.
8. Bazlarla birleşerek tuz ve su oluştururlar. Bir asidin hidrojeni yerine metal veya amonyum iyonunun geçmesiyle oluşan bileşiğe tuz denir. Bir asit bazla birleştiğinde hem asit hem de baz özelliklerini kaybeder. Bu nedenle asitlerle bazlar arasındaki tepkimelere nötrleşme tepkimesi denir.
Nötrleşme, gerçekte H+ ve OH– iyonlarının birleşerek H2O oluşturmaları olayıdır. Bu nedenle nötrleşmenin net iyon denklemi;
H+(suda) + OH–(suda) → H2O(s)
asit baz nötr şeklindedir.
Asitler, yalnız bazlarla değil, bazik oksitlerlerle (metal oksitlerle) de tuzları oluşturur.
9. Asit oksitlerin su ile tepkimeleriyle elde edilirler.
SO3(g) + H2O(s) → H2SO4(suda)
Günlük Yaşamda Asitler
Sirke, seyreltik bir asetik asit çözeltisidir.Araba akülerinde sülfirik asit kullanılır.
Nitrik asit, boya ve gübre yapımında kullanılır.Temizlikte kullanılan tuz ruhu seyreltik hidroklorik asit çözeltisidir.
Midemiz de seyreltik hidroklorik asit salgılayarak besinleri parçalar. Bu salgının fazlalaşması midede ülsere sebep olur.
Bazı maddelerin yapısında hidrojen bulunmadığı hâlde, hidrojen iyonu (H+) oluşumuna sebep oldukları için sulu çözeltileri asit özelliği gösterir. CO2 ve SO2 suda asit özelliği gösteren maddelerdir.Havadaki karbon dioksit ve kükürt dioksit gazları da yağmur damlalarında çözündüklerinde asit olarak yere düşer. Asit yağmurları bu şekilde oluşur.
Bazların Özellikleri
1. Suda iyon oluşturarak çözünürler. Çözeltileri elektrik akımını iletir.
2. Tatları acıdır. Sabun köpüğünün acılığı yapısındaki sodyum hidroksitten, karabiberin acılığı yapısındaki piperidin bazından ileri gelir.
3. Boya maddelerine etki ederler. Kırmızı turnusolu mavi, renksiz fenolftaleini pembe yaparlar.
4. Amfoter metallerle (Zn, Al, Pb, Sn…) tepkimeye girerek hidrojen gazı oluştururlar.
Al, Pb ve Sn da amfoter özellik gösterir. Bu elementlerin hem kendileri hem de oksitleri ve hidroksitleri amfoter özellik gösterir.
5. Elle tutulduklarında kayganlık hissi verirler. Sabunun, yumurta akının ve deniz suyunun kayganlıkları yapılarındaki bazlardan kaynaklanır.
6. Asitleri nötrleştirirler. Yani asitlerle veya asit oksitlerle tuzları oluştururlar.
7. Metal oksitlerin su ile tepkimesinden elde edilirler.
Bazların Kullanım Alanları
Sodyum hidroksit (NaOH) sabun yapımında kullanılır.Bu yüzden sabun ağzımıza ve gözümüze değdiğinde acı verir.
Diş macunu ve şampuanlarda da baz olduğu için acı tat verir.
Amonyaklı sıvı maddeler, yağ ve kireç sökücü olarak ev temizleyicilerinde kullanılır.
Yemek sodası olarak bilinen kabartma tozu, bir çeşit baz olan sodyum bikarbonat içerir.
Kireç suyu bir çeşit bazdır.
Potasyum hidroksit, KOH arap sabunu yapımında kullanılır.
Bazlar ve asitler tepkimeye girerek tuz ve su oluşturur.
Baz + Asit Tuz + Su
7. Karbonat ve bikarbonatlarla tepkimeye girerek CO2 gazı oluştururlar.
8. Bazlarla birleşerek tuz ve su oluştururlar. Bir asidin hidrojeni yerine metal veya amonyum iyonunun geçmesiyle oluşan bileşiğe tuz denir. Bir asit bazla birleştiğinde hem asit hem de baz özelliklerini kaybeder. Bu nedenle asitlerle bazlar arasındaki tepkimelere nötrleşme tepkimesi denir.
Nötrleşme, gerçekte H+ ve OH– iyonlarının birleşerek H2O oluşturmaları olayıdır. Bu nedenle nötrleşmenin net iyon denklemi;
H+(suda) + OH–(suda) → H2O(s)
asit baz nötr şeklindedir.
Asitler, yalnız bazlarla değil, bazik oksitlerlerle (metal oksitlerle) de tuzları oluşturur.
9. Asit oksitlerin su ile tepkimeleriyle elde edilirler.
SO3(g) + H2O(s) → H2SO4(suda)
Günlük Yaşamda Asitler
Sirke, seyreltik bir asetik asit çözeltisidir.Araba akülerinde sülfirik asit kullanılır.
Nitrik asit, boya ve gübre yapımında kullanılır.Temizlikte kullanılan tuz ruhu seyreltik hidroklorik asit çözeltisidir.
Midemiz de seyreltik hidroklorik asit salgılayarak besinleri parçalar. Bu salgının fazlalaşması midede ülsere sebep olur.
Bazı maddelerin yapısında hidrojen bulunmadığı hâlde, hidrojen iyonu (H+) oluşumuna sebep oldukları için sulu çözeltileri asit özelliği gösterir. CO2 ve SO2 suda asit özelliği gösteren maddelerdir.Havadaki karbon dioksit ve kükürt dioksit gazları da yağmur damlalarında çözündüklerinde asit olarak yere düşer. Asit yağmurları bu şekilde oluşur.
Bazların Özellikleri
1. Suda iyon oluşturarak çözünürler. Çözeltileri elektrik akımını iletir.
2. Tatları acıdır. Sabun köpüğünün acılığı yapısındaki sodyum hidroksitten, karabiberin acılığı yapısındaki piperidin bazından ileri gelir.
3. Boya maddelerine etki ederler. Kırmızı turnusolu mavi, renksiz fenolftaleini pembe yaparlar.
4. Amfoter metallerle (Zn, Al, Pb, Sn…) tepkimeye girerek hidrojen gazı oluştururlar.
Al, Pb ve Sn da amfoter özellik gösterir. Bu elementlerin hem kendileri hem de oksitleri ve hidroksitleri amfoter özellik gösterir.
5. Elle tutulduklarında kayganlık hissi verirler. Sabunun, yumurta akının ve deniz suyunun kayganlıkları yapılarındaki bazlardan kaynaklanır.
6. Asitleri nötrleştirirler. Yani asitlerle veya asit oksitlerle tuzları oluştururlar.
7. Metal oksitlerin su ile tepkimesinden elde edilirler.
Bazların Kullanım Alanları
Sodyum hidroksit (NaOH) sabun yapımında kullanılır.Bu yüzden sabun ağzımıza ve gözümüze değdiğinde acı verir.
Diş macunu ve şampuanlarda da baz olduğu için acı tat verir.
Amonyaklı sıvı maddeler, yağ ve kireç sökücü olarak ev temizleyicilerinde kullanılır.
Yemek sodası olarak bilinen kabartma tozu, bir çeşit baz olan sodyum bikarbonat içerir.
Kireç suyu bir çeşit bazdır.
Potasyum hidroksit, KOH arap sabunu yapımında kullanılır.
Bazlar ve asitler tepkimeye girerek tuz ve su oluşturur.
Baz + Asit Tuz + Su
Kaydol:
Yorumlar (Atom)